Solubilidade
Solubilidade ou coeficiente de solubilidade (CS) é a quantidade máxima que uma substância dissolver-se num líquido. Pode-se expressar em mols por litro, em gramas por litro, ou em percentagem de soluto/ solvente.
A solubilidade de uma substância é uma propriedade física muito importante, na qual se baseiam certos métodos de separação de misturas, de extração de produtos naturais e de recristalização de substâncias.
Também é uma propriedade muito empregada nas industrias de tintas, perfumes, sabões e detergentes, açúcares e plásticos. A solubilidade depende da natureza do soluto, do solvente e da temperatura.
Para prever o comportamento de certos solutos em relação a certos solventes (à temperatura constante) é necessário se analisar as suas estruturas moleculares, ou melhor, o tipo de interação que há entre soluto e solvente.
De acordo com as Regras de Solubilidade, uma substância polar tende a dissolver em um solvente polar, e uma substância apolar também num solvente apolar. Ou seja, semelhante dissolve semelhante. Por esse motivo as substâncias orgânicas em geral, só se dissolvem em líquidos também orgânicos, como, por exemplo, álcool, éter, benzeno, gasolina, etc. Esses líquidos recebem o nome de solventes orgânicos.
Outra consideração que devemos fazer é a seguinte: quando a temperatura de uma solução diminui ou quando o solvente evapora, o soluto tende a cristalizar, purificando-se, mas, devemos notar que:
- A cristalização de uma substância iônica é mais fácil, pois, os íons se atraem eletricamente;
- Pelo contrário a cristalização de uma substância molecular é mais difícil, pois a atração entre as moléculas é muito menor. A cristalização das substâncias orgânicas é em geral difícil e demorada. Existem certos compostos orgânicos como a parafina, que não se cristalizam. Os compostos orgânicos cristalinos surgem entre os compostos orgânicos bastante polares (caso dos açucares) ou entre os compostos orgânicos iônicos (como exemplo, os sais orgânicos).
Conclusões e conceitos importantes sobre o assunto





A experiência
A nossa experiência consistia colocar em prática todos os conceitos acima.
Procedimento
Materiais
- balança analítica;
- 3 tubos de ensaio limpos e secos;
- 1 pipeta volumétrica;
- dicromato de potássio;
- água destilada;
- estante para tubo de ensaio;
Sequência e resultado
Nossa experiência foi realizada em três etapas. O que variou em cada etapa foi a quantidade de dicromato utilizado. A temperatura da água destilada, foi a temperatura ambiente em todas as fases
Primeiramente separamos os três tubos de ensaio, depois utilizando a pipeta volumétrica medimos em cada tubo de ensaio 10 ml de água destilada.
Depois disso iniciamos a experiência:
- Tubo 1
O tubo de ensaio 1 deveria conter 0,25 gramas de dicromato de potássio.
Fomos para a balança, ajustamos as configurações da balança e a quantidade de dicromato que utilizados foi de aproximadamente 0,3 gramas.
Depois colocamos o dicromato no tubo de ensaio e agimos o tubo de ensaio para o dicromato poder se dissolver na solução.
O resultado entrado foi que o dicromato se dissolveu completamente, sem a formação de corpo de chão, formando assim uma solução homogênea. A cor obtida pela solução foi um tom alaranjado.
- Tubo 2
O tubo de ensaio 2 deveria conter 0,5 gramas de dicromato de potássio.
Fomos para a balança novamente, ajustamos as configurações da balança e a quantidade de dicromato que utilizados foi de 0,5 gramas.
Depois colocamos o dicromato no tubo de ensaio e agimos o tubo de ensaio para o dicromato poder se dissolver na solução.
O resultado encontrado foi que a solução obteve um tom alaranjado, sem nenhuma mudança neste aspecto com o anterior, porém nesta solução ocorreu a formação de corpo de chão , dessa forma esta foi uma solução supersaturada.
- Tubo 3
O tubo de ensaio 3 deveria conter 1 grama de dicromato de potássio.
De novo fomos para a balança, ajustamos as configurações da balança e a quantidade de dicromato que utilizados foi de 1 grama.
Depois colocamos o dicromato no tubo de ensaio e agimos o tubo de ensaio para o dicromato poder se dissolver na solução.
O resultado encontrado foi que a solução obteve um tom alaranjado, sem nenhuma mudança neste aspecto com os demais tubos, porém nesta solução ocorreu uma maior formação de corpo de chão , dessa forma esta também foi uma solução supersaturada, a diferença desta com a anterior foi que ocorreu uma maior formação de corpo de chão.
Conclusão
Não podemos afirmar que é com base no tubo 1 que podemos retirar o coeficiente de solubilidade do dicromato, pois existe uma diferença, apesar de pequena, entre a quantidade de dicromato no tubo 1 e no tubo 2, dessa forma, não sabemos a partir de qual quantidade é formado o corpo de chão, assim não sabemos a quantidade suficiente de dicromato necessária para tornar a mistura de dicromato e água uma solução saturada. A única coisa que podemos afirmar é que a solução do tubo 1 é uniforme mas não que ela é saturada. Talvez a cor poderia nos dar esta resposta, mas este é um dado tão subjetivo e impreciso, que nem pode ser levado em consideração.
Já nos tubos 2 e 3 existem algumas possibilidades para explicar a formação do corpo de chão.
- Temperatura
A temperatura é um fator muito importante na solubilidade. O calor aumenta o grau de agitação das moléculas, agitação essa que gera mais espaço entre as moléculas. Esses espaços podem ser ocupados pelo soluto, assim isso poderia ter diminuído ou até eliminado, dependendo do caso, o corpo de chão.
- Polaridade


 É importante notarmos dois patamares de temperatura: um corresponde ao ponto de fusão e o outro ao de ebulição. Outra coisa a ser lembrada: em temperaturas inferiores ao ponto de fusão a amostra é sólida; em temperatura entre o ponto de fusão e o de ebulição é líquida; em temperaturas acima do ponto de ebulição a amostra á gasosa. Exatamente no ponto de fusão coexistem as fases sólida e líquida e, exatamente no ponto de ebulição coexistem as fases líquida e gasosa.
É importante notarmos dois patamares de temperatura: um corresponde ao ponto de fusão e o outro ao de ebulição. Outra coisa a ser lembrada: em temperaturas inferiores ao ponto de fusão a amostra é sólida; em temperatura entre o ponto de fusão e o de ebulição é líquida; em temperaturas acima do ponto de ebulição a amostra á gasosa. Exatamente no ponto de fusão coexistem as fases sólida e líquida e, exatamente no ponto de ebulição coexistem as fases líquida e gasosa.
 A experiência
A experiência 


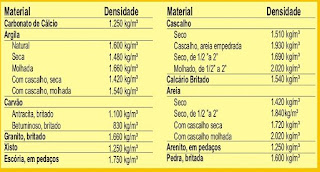
 Portanto, a densidade é igual à:
Portanto, a densidade é igual à:

 Densidade Média:
Densidade Média: 