A primeira experiência realizada por nosso grupo, tem como objetivo colocar em prática o conceito de densidade. Mas antes de falarmos sobre a experiência vamos falar um pouco sobre o que é densidade.
DENSIDADE
Por definição, densidade (d) é a relação (razão) entre a massa de um material e o volume por ele ocupado. Ou seja:

Para sólidos e líquidos, a densidade geralmente é expressa em gramas por centímetros cúbicos, (g/cm3). Para gases, costuma ser expressa em gramas por litro, (g/L).
A densidade de uma mesma substância depende do estado físico e da temperatura. No caso dos gases, além desses fatores inclui- se também a pressão.
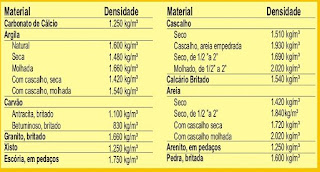
Valores normais de densidade para algumas substâncias:
A densidade da água à pressão normal e à temperatura de 25 ºC, é de 1,00 g/cm³, e a 4 ºC, onde se atinge sua densidade máxima, é de 1,03 g/cm³.
O gelo ou, água no estado sólido, possui uma massa volúmica inferior àquela apresentada pela água em seu estado líquido (0,97 g/cm³), propriedade rara nos líquidos, que se explica pela polaridade da molécula da água e pelo aumento da distância média entre partículas.
Esta tabela mostra a densidade de algumas substâncias:
A densidade de uma mesma substância depende do estado físico e da temperatura. No caso dos gases, além desses fatores inclui- se também a pressão.
Valores normais de densidade para algumas substâncias:
A densidade da água à pressão normal e à temperatura de 25 ºC, é de 1,00 g/cm³, e a 4 ºC, onde se atinge sua densidade máxima, é de 1,03 g/cm³.
O gelo ou, água no estado sólido, possui uma massa volúmica inferior àquela apresentada pela água em seu estado líquido (0,97 g/cm³), propriedade rara nos líquidos, que se explica pela polaridade da molécula da água e pelo aumento da distância média entre partículas.
Esta tabela mostra a densidade de algumas substâncias:
A experiência
A experiência consistia em calcular a densidade da água em diferentes volumes e massas, porém em mesmas condições de estado e temperatura.
Procedimento
Material
- Água;
- Uma proveta graduada;
- Balança.
Sequência e resultado
Primeiramente medimos na balança a massa da proveta, que era 78g. Depois disso, decidimos que utilizaríamos a medida de 50 ml e de 100 ml de água.
Utilizando os 50 ml:
Colocarmos a água, com a medida indicada, dentro da proveta e depois fomos para a balança onde medimos massa dos 50 ml de água + a proveta. A massa dos dois é igual a 126,6 g, porém para medirmos a densidade da água, não podemos incluir a massa da proveta, portanto temos que fazer a seguinte conta:
 Portanto, a densidade é igual à:
Portanto, a densidade é igual à:
Utilizando os 100 ml:
Novamente, colocamos a água, com a medida indicada, dentro da proveta e depois fomos para a balança onde medimos massa dos 100 ml de água + a proveta. A massa dos dois é igual a 176 g, porém, novamente, para medirmos a densidade da água, não podemos incluir a massa da proveta, portanto temos que, novamente fazer a seguinte conta:
Novamente, colocamos a água, com a medida indicada, dentro da proveta e depois fomos para a balança onde medimos massa dos 100 ml de água + a proveta. A massa dos dois é igual a 176 g, porém, novamente, para medirmos a densidade da água, não podemos incluir a massa da proveta, portanto temos que, novamente fazer a seguinte conta:

Portanto, a densidade é igual à:
 Densidade Média:
Densidade Média: 
Conclusão
Comparando a densidade tabelada da água e a que nós encontramos, existe uma pequena variação, cujo valor é igual à 0,025. Apesar de pequena esta é uma variação. Nós levantamos as seguintes hipóteses para tal acontecimento:
- Temperatura
A densidade da água tem valor de 1 g/cm3, quando esta se encontra na temperatura de 25oC. Como nós não medimos a temperatura da água utilizada, não temos certeza da temperatura em que ela se encontrava. Portanto, a água utilizada podia ter uma temperatura superior, ou inferior, ou até igual a temperatura utilizada para tabelar os valores da densidade. Por esse motivo, a temperatura pode Ter sido o fator que causou a variação. - Pureza
Outro fator que poderia ter causado a variação, é a pureza da água. Talvez a água
utilizada para o nosso experimento apresente um nível de pureza diferente àquela utilizada para tabelar os valores de densidade apresentados acima, o que causaria uma variação. - Pressão
A pressão também é um fator que levaria a essa variação, pois a pressão varia de
acordo com a sua localidade. Por exemplo, uma pessoa que habita Campos do Jordão, vive sobre uma determinada pressão, outra pessoa que habita Santos, por exemplo, vive sobre outra pressão. Essa variação pode ter, acontecido pois lugar onde os valores tabelados foram realizados apresentam uma determinada pressão, já o lugar onde nós realizamos a nossa experiência, pode ter uma pressão inferior, superior ou até igual àquela onde o valor tabelado foi dado. - Erros de execução
O ultimo fator consiste em também incluirmos a esta lista o nosso próprio descuido
na hora da realização de nossa experiência, podemos ter errado na dosagem dos materiais envolvidos, nas medições, ou até nas anotações os resultados.